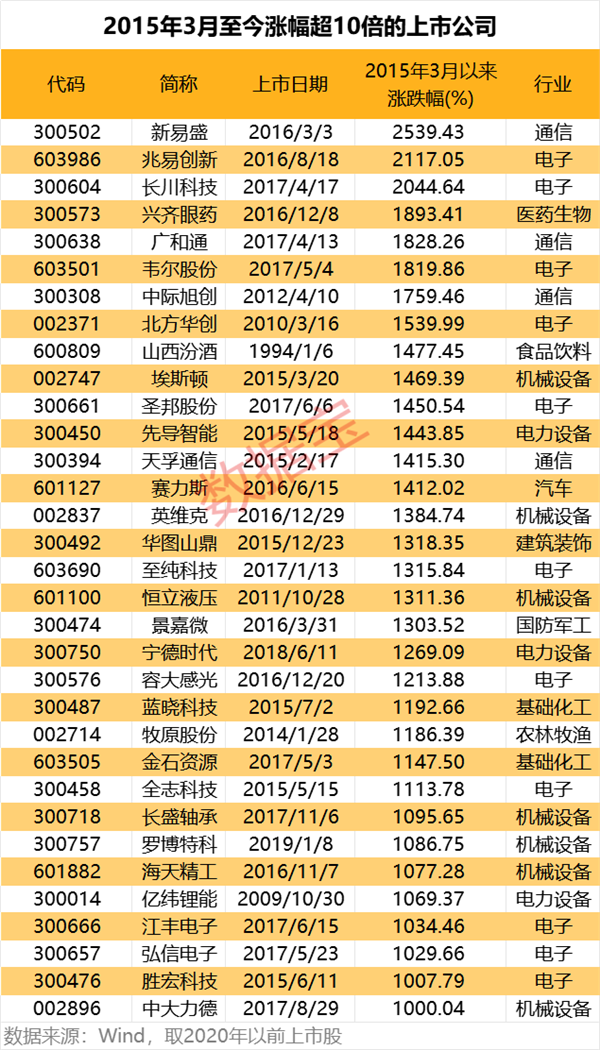
中信证券股份有限公司
关于悦康药业集团股份有限公司
变更部分募集资金投资项目的核查意见
中信证券股份有限公司(以下简称“中信证券”“保荐机构”)作为悦康药业集
团股份有限公司(以下简称“悦康药业”“公司”)的保荐机构,根据《证券发行上
市保荐业务管理办法》《上市公司监管指引第2号――上市公司募集资金管理和使用的
监管要求》《上海证券交易所科创板股票上市规则》《上海证券交易所科创板上市公
司自律监管指引**号――规范运作》等有关规定,对公司变更部分募集资金投资项目
的事项进行了核查,具体情况如下:
一、募集资金基本情况
根据**证券监督管理委员会于2020年11月6日出具的《关于同意悦康药业集团股
份有限公司**公开发行股票注册的批复》(证监许可〔2020〕2929号),公司获准向
社会公开发行人民币普通股90,000,000股,每股发行价格为人民币24.36元,募集资金
总额为219,240.00万元;扣除承销及保荐费用、发行登记费以及其他交易费用共计
部到位,经容诚会计师事务所(特殊普通合伙)审验并于2020年12月18日出具了《验
资报告》(容诚验字2020230Z0290号)。
募集资金到账后,已**存放于经公司董事会批准开设的募集资金专项账户内,
公司已与保荐机构、存放募集资金的商业银行签署了募集资金三方监管协议。
二、募集资金投资项目情况
截至 2024 年 12 月 31 日,公司**公开发行股票募集资金投资项目的实际投资情
况如下:
单位:人民币万元
截至2024
预计募集 年12月31 募集资金投
编
项目名称 投资总额 资金投入 日募集资 入进度 项目状态
号
金额 金累计投 (%)
入
药研发项目
固体制剂和小容量水
设项目
原料药技术升级改造
项目
智能编码系统建设项
目
智能化工厂及绿色升
级改造项目
合计 151,500.00 150,500.00 112,169.63 - -
注:本次募集资金净额为201,751.55万元,其中超额募集资金金额为51,251.55万元。
三、本次使用募集资金投资“新药研发项目”的具体原因
公司于2024年12月18日、2025年1月3日召开第二届董事会第十七次会议、第二届
监事会第十五次会议、2025年**次临时股东大会,分别审议通过了《关于终止部分
募集资金投资项目的议案》,同意公司终止**公开发行股票募集资金投资项目“智
能编码系统建设项目”。该项目原计划总投资为8,000万元,截至2024年11月30日,该
项目尚未投入募集资金,剩余募集资金金额8,530.34万元(含利息收入及现金管理收
益 ) 。 具 体 情 况 详 见 公 司 2024 年 12 月 19 日 披 露 于 上 海 证 券 交 易 所 网 站
(www.sse.com.cn)的《悦康药业集团股份有限公司关于终止部分募集资金投资项目
的公告》(公告编号:2024-059)。
为提高募集资金的效率,公司综合市场及行业环境变化,结合未来战略发展规划
和实际情况,拟将前期终止的募集资金投资项目“智能编码系统建设项目”剩余募集
资金投向新设的“新药研发项目”,该“新药研发项目”预计投入资金8,500万元。
四、“新药研发项目”的具体情况
近年来,公司聚焦心脑血管、抗肿瘤、传染病等核心适应症领域尚未被满足的临
床需求,**布局小核酸**、mRNA疫苗、多肽**等技术路线,努力构建科学、
丰富的产品管线,以保障公**期可持续发展。本次拟使用募集资金投入“新药研发
项目”,其包括多肽**、小核酸**和mRNA疫苗三个研发方向。
项目 投入募集资金
子项目 产品代号 适应症 研发目标
名称 金额(万元)
多肽药 YKYY018 **RSV感染 完成IND申报 2,100
物 小计 2,100
YKYY013 **慢性乙肝 完成IND申报 1,550
小核酸
YKYY032 预防动脉粥样硬化风险 完成IND申报 2,600
新药 **
研发 小计 4,150
项目
mRNA YKYY031 **晚期实体瘤 完成IND申报 2,250
疫苗 小计 2,250
合计 8,500
(一)多肽**
以抗病毒多肽**(YKYY017)的开发为契机,公司组建了专业的多肽**研发
队伍,建立了多肽**开发平台,围绕呼吸道病毒进行了系列管线布局。
呼吸道合胞病毒(RSV)感染已成为导致5岁以下儿童及65岁以上老人发生严重肺
炎的核心因素,根据《柳叶刀》报告,2019年全球5岁以下儿童RSV相关急性下呼吸道
感染病例高达3300万例,住院患儿约360万例,死亡病例逾10万例,其中近一半死亡
(近4.6万例)发生在6个月以下的儿童中。目前,全球范围内尚无**RSV感染的特
效药获批上市。
为解决临床痛点,公司正在开发**基于AI研发的多肽膜融合抑制剂YKYY018。
本项目基于自主创新的一系列AI算法模型,结合**的多肽片断相互作用研究新理念,
通过生成式AI模型捕获更复杂的多肽受体关系,产生特定的抗病毒候选多肽,通过结
合先进的Star-Tran**ormer和Vision-Tran**ormer(ViT)架构,提高多肽**筛选的效率
和准确性,同时采用Shapley Additive exPlanatins (SHAP)分析有助于解释多肽活性和
毒性,指导设计更有效的抗病**物,**获得具有自主知识产权的抗RSV多肽先导
化合物。
已有数据显示,公司拟开发的RSV****预期具备良好的疗效、安全性和更优
的给**式,差异化市场竞争优势更为显著;公司拟使用募集资加速推进YKYY018的
临床前研发进程,募集资金的投入将有利于夯实公司在RSV**及预防新药研制领域
的核心竞争力,符合公**期发战略发展的要求。
(二)小核酸**
公**期专注于小核酸**的研发,已成功将以注射用CT102、YKYY015注射液
为代表的小核酸**推进至临床阶段。
小核酸**由经过特定设计的核苷酸序列和递送系统构成,主要作用于细胞质的
mRNA,从而调控特定蛋白质的表达,达到**疾病的目的。小核酸**作为新一代
分子实体,与传统的小分子化学药和抗体类**相比,具有研发周期短、**效果持
久、研发成功率较高和**领域广等优点,针对代谢疾病、感染等在内的小核酸**
具备优势的疾病领域,我国目标患者基数较大,小核酸**在我国具有较大市场潜力。
公司小核酸新药研发项目所选疾病方向涵盖了心血管、乙肝等慢性疾病**领域,
希望能解决现有**手段的难点、痛点,带来显著临床优势。公司重视小核酸**领
域技术的知识产权保护,建立了包括专利检索、专利分析、专利申请、专利维护在内
的全流程专利管理体系,围绕在研小核酸产品已经布局多件专利申请,保障公司在小
核酸技术领域的竞争优势与技术壁垒。截至本公告披露日,已递交超20件涉及小核酸
项目的专利申请,并获得授权12件。
乙肝是一种由乙型肝炎病毒(HBV)诱发的传染性肝炎,可通过母婴、性接触、
体液等途径传播。根据慢性乙型肝炎基层诊疗指南,慢性乙型肝炎病毒感染指乙型肝
炎表面抗原(HBsAg)和/或HBV DNA)阳性6个月以上,慢性乙型肝炎(CHB)指由
HBV持续感染6个月以上引起的慢性肝脏炎症性疾病。根据《慢性乙型肝炎防治指南
(2022年版)》,HBV感染呈世界性流行,2019年全球一般人群HBsAg流行率为3.8%,约
有150万例新发HBV干扰者,2.96亿例慢性感染者,82万例死于HBV感染所致的肝衰竭、
肝硬化或HCC等相关疾病。2014年**CDC调查结果显示,我国1-29岁人群的HBsAg
阳性率为2.94%,5岁以下儿童为0.32%。据估计,目前我国全人群HBsAg流行率为5%-
致的医疗负担沉重,但大多数HBV感染者对自身感染状况知晓率仍较低,据估计2022
年我国慢性乙型肝炎的诊断率和**率仅分别为22%和15%,导致部分患者就医时已
经进展到疾病晚期。
功能性**为目前可及的临床**理想终点。临床**即完成有限疗程**后,
血清HBsAg和HBV DNA持续检测不到,HBeAg阴转,伴或不伴HBsAg血清学转换,残
留cccDNA可持续存在,肝脏炎症反应缓解和肝组织病理学改善,终末期肝病发生率显
著**。临床**类似于急性HBV感染后自发性病毒**的状态,标志着CHB的**
免疫学控制,是目前**外指南推荐的理想**目标。根据官方指南,HBsAg阴转时
的年龄≥50岁是发生肝细胞癌的危险因素之一。因此,对于适合的优势人群应尽可能
追求早期功能性**。与****不同,临床**可在优势CHB患者中通过优化**
方案实现。
目前批准的慢性乙肝抗病**物包括免疫调节剂(如聚乙二醇干扰素)以及直接
作用于病毒复制周期不同靶点的直接抗病**物(如核苷类似物)。有限疗程的免疫调
节剂或长期抗病**物的**可获得持续生物化学和病毒学应答,肝脏组织学改善,可显
著**但无法****肝细胞癌发生风险。然而现阶段单独应用免疫调节剂或直接抗
病**物均难以实现HBsAg**。
小核酸**可实现HBsAg的迅速**,联合**方案应用前景良好。血清中
HBsAg检测不到(定义为HBsAg<0.05 IU/mL)是乙肝功能性**的重要标准,小核酸
**可直接作用于HBV RNA,根据部分在研小核酸**已读出的临床实验数据,
bepirovirsen、VIR-2218等小核酸**可快速**慢乙肝患者的HBsAg水平,但患者
HBsAg水平往往在停药后出现反弹。目前多个在研小核酸**临床试验方案设置了联
用/序贯抗病**物或长效干扰素的对照组,以期进一步改善患者的临床获益。
YKYY013以乙肝病毒基因S和X ORF为靶标,从基因层面这一“源头”出发,直
接对目标基因表达进行调控,进而发挥药理功效,用以对抗乙型病毒性肝炎。可克服
目前核苷类**停药易复发,易耐药,干扰素类**应答不足等局限,运用自主研发的新
型GalNAc递送系统和新型siRNA点位修饰技术,提升药效,延长**作用周期,有望
成为一款突破性siRNA乙肝功能性**疗法。公司拟使用募集资加速推进YKYY013的
临床前研发进程。
动脉粥样硬化性心血管疾病(ASCVD)居全球心血管疾病(CVD)**,并成为
当今全球人类死亡的首要原因。血脂异常是ASCVD发生、发展的核心机制,并列为可
纠正危险因素。
由RESEARCH AND MARKETS数据显示,2021年全球高血脂症**市场为220亿
美元,至2027年全球高血脂症**市场份额将突破248亿美元,市场预测年复合增长率
为2.3%。行研报告显示,2022年**降脂药行业市场规模约为470亿元,年复合增长
率达到10.0%。据医药魔方流行病学统计数据显示,2010-2023年期间,我国18岁及以
上血脂异常患者数量由3.7亿人增长至7亿人,年增长率接近4%,6-17岁血脂异常患者
数量由4189万人增长至5518万人,年增长率接近2%,并在2024年将分别达到7.3亿人
和5621万人。按照我国临床研究数据计算,约有20-25%人口的Lp(a)水平偏高,且与增
加的心血管事件发生的风险相关。
对于动脉粥样硬化及其引发的心血管事件,《**血脂管理指南(2023年)》指出,
主要以中等剂量他汀类**为初始**,他汀类****后低密度脂蛋白胆固醇
(LDL-C)未达标时考虑联合胆固醇吸收抑制剂和/或前蛋白转化酶枯草溶菌素9(PCSK9)
抑制剂。但同时,《指南》中也指出,大量流行病学和遗传学研究显示,Lp(a)与
ASCVD及主动脉瓣钙化密切相关,Lp(a)水平升高是ASCVD的独立风险因素。目前尚
没有**被批准专门用于**Lp(a),且采取改变生活方式和传统降脂**均收效甚微。
目前**有效**Lp(a)水平的方法是脂质分离术,但该**手段对设备要求高,价格
昂贵且需要每1或2周进行2-**的**。综合来看,目前市面上尚未有特异有效且患
者依从性高的下调血浆Lp(a)浓度的**。
YKYY032是一款靶向脂蛋白(a)(Lp(a))基因LPA的皮下注射siRNA**,正被开
发用于抗动脉粥样硬化。Lp(a)是ASCVD和钙化性主动脉狭窄的致病危险因素。该药
物可以与LPA基因结合并暂时阻断其作用,从而达到**Lp(a)的目的。该**使用自
主研发的新型GalNAc递送系统和新型siRNA点位修饰技术,提升药理活性,延长**
作用周期,极大提高患者依从性。公司拟使用募集资加速推进YKYY032的临床研发进
程。
(三)mRNA疫苗
公**期聚焦mRNA疫苗**研发,用于预防带状**的YKYY026 mRNA疫苗和
用于预防RSV引起的下呼吸道疾病的YKYY025 mRNA疫苗已成功获批FDA临床试验;
两款产品的**IND申请已获受理。此两款产品的FDA临床获批,充分验证了公司
mRNA平台的开发能力及技术优势。
YKYY031 mRNA肿瘤疫苗为公司以**晚期实体瘤为目标开发的一款编码肿瘤特
异性抗原的mRNA疫苗。该**运用了具备**自主知识产权递送系统,可以**包
载编码特异性抗原的mRNA,不仅能有效促进肿瘤抗原mRNA的摄取、表达与处理,
还能提升新抗原的递呈效率,激活特异性T细胞,从而实现肿瘤**的目标。肿瘤
mRNA疫苗将进一步夯实公司肿瘤新药研发管线,公司拟使用募集资金加速推进
YKYY031的临床前研发进程。
五、本次募投项目投资的可行性分析
公司秉承创新驱动发展理念,打造高壁垒的核心技术平台,连续获得两次**科
技进步二等奖,且连续多年入选**医药工业百强及****医药研发产品线最
佳工业企业。二十余年发展历程中公司始终秉承创新驱动发展的理念,不断优化生产
技术、生产工艺创新,持续提升药品制剂的质量和疗效水平,并将研发成果运用至现
有产品中。公司围绕核酸、细胞与基因**、多肽、小分子化药和特色中药制剂五大
前沿技术路线,搭建起包括AI全流程研发、核酸**、细胞与基因****等在内的
十一大核心技术平台,构建起从临床前研究到商业化的全链条**化研发体系,与国
际先进的研发理念和标准接轨,确保研发成果在全球范围内的竞争力。
以未被满足的临床需求为向导,公司专注于创新型**的研制及商业化。研发团
队聚焦心脑血管、抗肿瘤、传染病三大核心适应症领域尚未被满足的临床需求,研发
成果与**临床需求紧密结合。
公司积极构建**且系统的平台技术体系,为创新药研发筑牢根基。在创新药领
域深入布局,不断攻克**化进程中的技术难题,在AI靶点发现、序列优化设计、
LNP递送、GalNAc递送、TLP递送、肝外靶向递送、核苷单体修饰、共加帽等底层关
键技术上取得了重大突破,达到****水平,彰显了公司在全球技术竞争中的优势
地位。
公司**开展产学研战略合作,建立了以企业为主导的全方位创新体系。重视与
**外科研院所的交流合作,时刻跟进**外先进技术的发展趋势,拥有核酸**国
家地方联合工程研究**、核酸**浙江省工程**、头孢**晶型研究**地方联
合工程实验室、心脑血管北京市工程研究**等一系列技术先进的工程**,为公司
提供了一系列关键技术,为药品研发奠定了良好的创新基础,构建了较强的**创新
能力。
公司充分发挥院士专家工作站、博士后科研工作站和博导工作站的技术优势,构
建了完善的校企联合创新和成果转化机制。公司建立了一支专业化、多元化、**化
的研发团队,2024年末公司拥有研发人员500余人,其中来自**外知名院校、科研院
所的教授、博士70多位。各个平台均配备了专业的技术人才队伍,涉及化学与分子生
物学、分子免疫学、生物工程学、神经生物学、药理毒理学、化学合成与工艺、制剂
学、生物分析、分析化学、临床医学、知识产权等不同专业技术领域,形成了从创新
药与仿制药的选题立项与合作、药学开发、药理毒理研究、临床研究、知识产权**
化布局到**外临床试验及****注册申报的专业技术部门,构建了完整的研发体
系,**地支撑和保障了公司创新药和仿制药的研发。
公司高度重视知识产权保护工作,围绕在研产品及早期项目,已经建立了包括专
利检索、专利分析、专利申请、专利维护在内的全流程专利管理体系,针对布局产品
制定了详实的专利保护策略,不断加固专利保护壁垒、延伸专利保护期限,为募投项
目的实施提供了必要的技术支持和法律保障。
目前,公司已获得300余项海内、外专利授权,专利覆盖范围涉及欧美、亚洲等多
个**市场,彰显了公司在全球技术竞争中的优势地位。
六、本次投资“新药研发项目”对公司的影响及风险提示
公司本次拟使用节余募集资金投入的“新药研发项目”包括多肽**研发、小核
酸**研发及mRNA疫苗研发三个方向,与公司**布局小核酸**、mRNA疫苗、
多肽**等技术路线,围绕心脑血管、抗肿瘤、传染病等核心适应症领域的发展布局
保持一致。投资“新药研发项目”有利于合理优化资源配置,提高募集资金的使用效
率,满足公司日常生产经营需要,符合公司经营的实际情况和长期发展战略,符合中
国证监会、上海证券交易所关于上市公司募集资金管理的相关规定,不存在损害公司
及股东利益的情形。
但由于医药产品具有高科技、高风险、高附加值的特点,药品从研制、临床试验
报批到投产的周期长、环节多、风险高,药品审评审批时间、审批结果及后续研究进
程、研究结果和未来产品市场竞争形势均存在诸多不确定性。
七、董事会和监事会的审议情况
(一)董事会审议情况
公司于 2025 年 3 月 14 日召开第二届董事会第十八次会议,审议通过了《关于变
更部分募集资金投资项目的议案》。董事会认为:公司本次变更部分募集资金投资项目
是公司根据实际经营情况和发展规划做出的审慎决策,将节余募集资金投向新的研发
项目,有利于公司相关研发项目的顺利实施和推进,有助于提高募集资金使用效率,
符合相关法律法规等制度规定,不存在变相改变募集资金用途和损害公司及股东利益
的情况。
(二)监事会审议情况
公司于 2025 年 3 月 14 日召开第二届监事会第十六次会议,审议通过了《关于变
更部分募集资金投资项目的议案》。监事会认为:公司本次变更部分募集资金投资项目
是公司根据实际经营情况和未来发展规划做出的审慎决策,将节余募集资金投向新的
研发项目,有利于推动相关研发项目的顺利开展,进一步提升公司的研发实力。且本
次变更内容和审议程序符合相关法律法规等制度要求,不存在变相改变募集资金用途
和损害公司及股东利益的情况。
八、保荐机构核查意见
经核查,保荐机构中信证券股份有限公司认为:公司本次变更部分募集资金投资
项目的事项已经董事会、监事会审议通过,该事项尚需提交股东大会,相关审议程序
符合《上海证券交易所股票上市规则》《上海证券交易所上市公司自律监管指引第 1 号
――规范运作》《上市公司监管指引第 2 号――上市公司募集资金管理和使用的监管要
求》等相关法律法规和规范性文件的要求。保荐机构对本次变更部分募集资金投资项
目事项无异议。
(以下无正文)
(本页无正文,为《中信证券股份有限公司关于悦康药业集团股份有限公司变
更部分募集资金投资项目的核查意见》之签字盖章页)
保荐代表人:
洪立斌 王天祺
中信证券股份有限公司
年 月 日